This Week at NEJM.org
May 2, 2024 Vol. 390 No. 17
May 2, 2024
Vol. 390 No. 17
This Week in the JOURNAL
ORIGINAL ARTICLES
-
マラリア予防のためのモノクローナル抗体
Monoclonal Antibody to Prevent Malariaマラリアは世界的に疾病の主要な原因である.マリで行われた第 2 相試験で,小児に対する熱帯熱マラリア原虫(Plasmodium falciparum)を標的とするモノクローナル抗体 L9LS の単回皮下投与は,臨床的マラリアの発生を抑制した.
-
心筋梗塞後の ApoA1 と転帰
ApoA1 and Outcomes after Myocardial Infarction急性心筋梗塞を発症し,多枝冠動脈疾患とその他の心血管リスク因子を有する患者では,CSL112(ヒト血漿由来アポリポ蛋白 A1 [ApoA1])により,心筋梗塞,脳卒中,心血管系の原因による死亡のリスクは低くならなかった.
-
大動脈弁狭窄症に対する TAVI と SAVR との比較
TAVI or SAVR in Aortic-Valve Stenosis重症大動脈弁狭窄症を有する手術低リスクまたは中等度リスクの患者を対象とした無作為化試験で,経カテーテル大動脈弁移植術(TAVI)は,1 年の時点で,外科的大動脈弁置換術(SAVR)に対して非劣性であったことが示された.
-
先天性 TTP に対する組換え ADAMTS13
Recombinant ADAMTS13 in Congenital TTP先天性血栓性血小板減少性紫斑病(TTP)は,ADAMTS13 の遺伝的欠損に起因する疾患である.組換え ADAMTS13 の予防的投与により,血中 ADAMTS13 は正常化し,毒性は少なく,中和抗体は出現しなかった.
REVIEW ARTICLE
-
多様な宿主におけるクリプトコッカス症
Cryptococcal Disease in Diverse Hosts
クリプトコッカス症により,年間 18 万人もの人が死亡し,HIV 関連髄膜炎症例の 68%が本症を有している.この総説では,診断・予防・治療戦略と,炎症性症候群の病態生理学的役割について考察している.
Videos, Images, and Multimedia
IMAGES IN CLINICAL MEDICINE
-
急性前骨髄球性白血病
Acute Promyelocytic Leukemia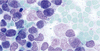
47 歳の男性が,2 日間続く脱力と発熱を訴えて受診した.臨床検査で汎血球減少が認められた.骨髄生検では,細胞内にアウエル小体を多数含む前骨髄球が認められた.
DOUBLE TAKE
-
うつ病 ― 理解し,同定し,診断する
Depression — Understanding, Identifying, and Diagnosing
うつ病に関する 4 部構成の動画の連続シリーズの初回では,プライマリケア医が自殺傾向をスクリーニング,診断,対処する能力を向上させる.
NEJM QUICK TAKE
-
マラリア予防のためのモノクローナル抗体
Monoclonal Antibody to Prevent Malaria
熱帯熱マラリア原虫(Plasmodium falciparum)により,年間 60 万人以上が死亡している.モノクローナル抗体 L9LS が,熱帯熱マラリア原虫の流行地域において,小児の熱帯熱マラリア原虫感染を防御できるかは明らかでない.新しい研究知見が短い動画にまとめられている.
-
心筋梗塞後の ApoA1 静脈内投与
ApoA1 Infusions after Myocardial Infarction
コレステロール引抜きの主要なメディエータであるアポリポ蛋白 A1(ApoA1)の静脈内投与が,心筋梗塞後の主要心血管イベントリスクを低下させるかは明らかでない.新しい研究知見が短い動画にまとめられている.
-
大動脈弁狭窄症に対する TAVI と SAVR との比較
TAVI or SAVR for Aortic-Valve Stenosis経カテーテル大動脈弁移植術(TAVI)は,外科的大動脈弁置換術(SAVR)の代わりに用いられることが増えているが,臨床診療でこの 2 つのアプローチを比較したエビデンスは少ない.新しい研究知見が短い動画にまとめられている.
-
先天性 TTP に対する組換え ADAMTS13
Recombinant ADAMTS13 in Congenital TTP
先天性血栓性血小板減少性紫斑病(TTP)は,ADAMTS13 の重度の遺伝的欠損に起因する疾患である.より良好な安全性プロファイルの予防的アプローチが必要とされている.新しい研究知見が短い動画にまとめられている.



